Si buscas
hosting web,
dominios web,
correos empresariales o
crear páginas web gratis,
ingresa a
PaginaMX
Por otro lado, si buscas crear códigos qr online ingresa al Creador de Códigos QR más potente que existe


La apoptosis:
la apoptosis o muerte celular programa, es un hecho normal en el que una secuncia organizada de fenomenos conduce ala muerte de la celula. la muerte por apoptosis es un proceso limpio y ordenado, caracterizado por el encojimiento del volumen de la celula y el nucleo, perdida de adhesion alas celulas contiguas, formacion de vesiculas en la superficie celuar , diseccion de la cromatina en pequeños fragmentos y englobamiento rapido del ´cadaver´por fagocitosis.
la apoptosis es fundamental en los siguientes procesos:
• Remodelado durante el desarrollo embrionario. Un ejemplo puede ser la eliminación de las zonas interdigitales
• Desarrollo de órganos y sistemas. El establecimiento del correcto circuito de conexiones neuronales durante el desarrollo necesita que las neuronas que no establezcan contactos sinápticos mueran por apoptosis. También en el establecimiento de un repertorio inmune adecuado es necesario que los linfocitos T que reconocen antígenos propios mueran en el proceso de selección negativa
• Mantenimiento de la homeostasis celular. Es crucial el manteniendo de un número determinado de células estableciendo un equilibrio entre división y muerte celular. En sistemas como la médula ósea o el aparato digestivo es especialmente importante que los procesos de apoptosis funcionen adecuadamente
• Defensa frente a patógenos. Células infectadas por virus o bacterias disparan procesos de apoptosis como defensa.
• Defensa frente al desarrollo de tumores. Procesos de apoptosis también protegen frente al desarrollo de algunos tipos de tumores.
Los estímulos que inducen apoptosis pueden ser extra o intracelulares. Citoquinas como el TNF, radiaciones, falta de señales hormonales o de factores tróficos son algunos ejemplos de estímulos extracelulares que inducen apoptosis. Mitosis incompleta, aumento de las especies reactivas de oxígeno, aumento del calcio citoplasmático o daños irreparables del ADN mediados por la molécula p53 son ejemplos de estímulos intracelulares que disparan procesos de apoptosis.
La apoptosis comienza con la activación de unas proteínas llamadas caspasas, que producen una cascada proteolítica que culmina con la hidrólisis de proteínas estructurales y de enzimas reparadoras de ADN y con la activación de enzimas hidrolíticas como las endonucleasas. Los estímulos extracelulares activan la caspasa 8 mientras que los intracelulares activan proteínas pro-apoptóticas e inhiben proteínas anti-apoptóticas de la familia Bcl-2. En respuesta a estímulos intracelulares o como vía alternativa promovida por la caspasa 8 (que vehicula los estímulos extracelulares) se forma el apoptosoma. La mitocondria está involucrada en la apoptosis inducida por daño o stress. En un primer momento se libera citocromo c al citoplasma. Éste se une a la proteína Apaf-1 que activa a la caspasa 9.
La apoptosis es un proceso ordenado, con una serie de fases: disminución del volumen celular y pérdida de las características de adhesión, degradación de proteínas y fragmentación del ADN, condensación cromatínica, aparición de burbujas en superficie, fragmentación del núcleo, formación de los cuerpos apoptóticos (rodeados de membrana) y fagocitosis de estos cuerpos apoptóticos por macrófagos. En ningún caso se vierte el contenido celular al exterior.
La apoptosis es un proceso muy finamente regulado. Si ocurre un exceso o un defecto de apoptosis, se producen diversas patologías como malformaciones, defectos en el desarrollo, enfermedades autoinmunes, enfermedades neurodegenerativas o aparición de tumores.
vias de la apoptosis:
via extrinseca de la apoptosis
via intrinseca de la apoptosis
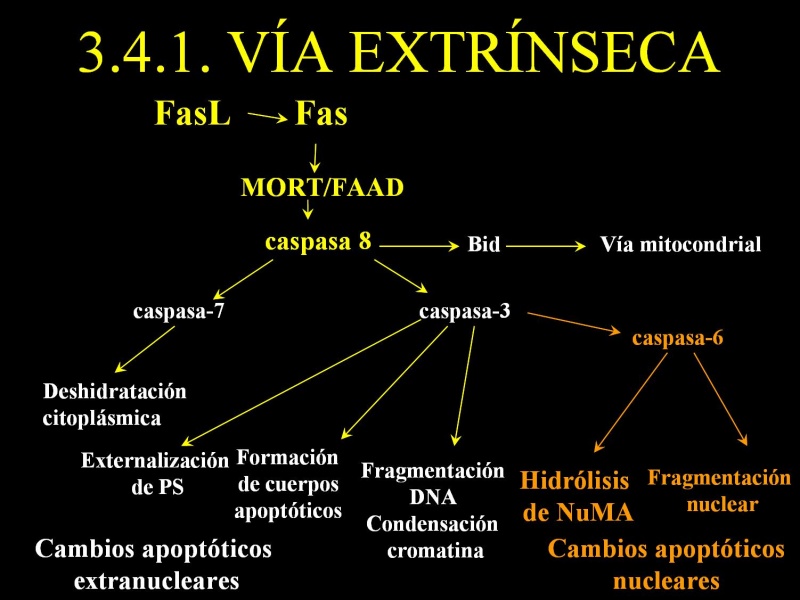
via extrinseca de la apoptosis:
Los receptores de muerte de la familia del receptor de TNF (TNFR) incluyen TNFR1, Fas (CD95), DR3/WSL y los receptores del ligando inductor de apoptosis relacionado con el TNF (TNF-related apoptosis-inducing ligand, TRAIL)/Apo-2L (TRAIL-R1/DR4, TRAIL-R2/DR5). Los miembros de esta familia están caracterizados por presentar de dos a cinco copias de un dominio extracelular rico en cisteína. Los receptores de muerte también poseen un dominio intracelular en el C-terminal del receptor denominado dominio de muerte (death domain, DD ). Cuando un ligando se une a estos receptores se puede producir la muerte por apoptosis de la célula que los posee.
El miembro de los receptores de muerte más estudiado y relevante en Inmunología es el CD95 o Fas. La oligomerización, más probablemente la trimerización, del CD95 tras la unión de su ligando, FasL, es requerida para la transducción de la señal apoptótica. Un complejo de proteínas se asocia con el CD95 activado. Este complejo de señalización inductor de muerte (death-inducing signalling complex,DISC ) se forma en el segundo de los receptores trimerizados. Primero, el adaptador FADD (Fas-associated death domain) o Mort1 se une a través de su dominio de muerte al dominio de muerte del CD95. FADD también presenta el denominado dominio efector de muerte (death-effector domain, DED ), y, de nuevo por interacciones homólogas, recluta en el DISC la procaspasa-8 (o FLICE) que contiene un DED. Después, la procaspasa-8 es activada proteolíticamente y la caspasa-8 activa es liberada del DISC al citoplasma formando un heterotetrámero de dos subunidades pequeñas y dos grandes (Muzio M, 1996). La caspasa-8 activa rompe varias proteínas de la célula incluyendo la procaspasa-3, que resulta en su activación y en la finalización de la muerte celular.
La inhibición de esta ruta es realizada por proteínas que contienen dos DED y que se unen al complejo CD95-FADD. Esto inhibe el reclutamiento y la activación de la caspasa-8, antiguamente conocida como FLICE, de ahí el nombre de proteínas inhibidoras de FLICE (FLICE-inhibitory proteins, FLIP ) (Thome M, 1997; Hu S, 1997; Bertin J, 1997; Yeh WC,2000).
La vía de los receptores de muerte y la vía mitocondrial convergen a nivel de la activación de la caspasa-3. El solapamiento y la integración de las dos vías se debe a Bid, un miembro proapoptótico de la familia de Bcl-2. La caspasa-8 media la ruptura de Bid incrementando enormemente su actividad proapoptótica que resulta en su translocación a la mitocondria donde promueve la liberación del citocromo c. Hay que tener en cuenta que en la mayoría de las condiciones, este solapamiento es mínimo, y las dos vías operan de manera independiente
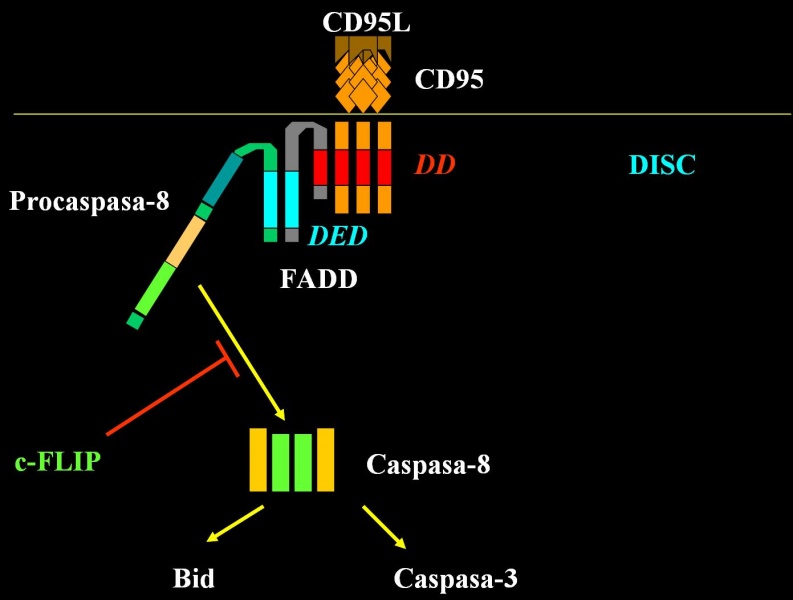
Mediante esta ruta de inducción de apoptosis se activa la caspasa-8 que activa otras caspasas que darán, en última instancia, el fenotipo apoptótico que nosotros detectamos mediante diferentes metodologías.

via intrinseca de la apoptosis
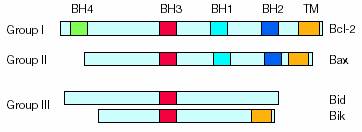
Como su nombre lo indica, la vía intrínseca se inicia dentro de la célula. Los estímulos internos, tales como un daño genético irreparable, la hipoxia, concentraciones extremadamente altas de calcio citosólico y un stress oxidativo severo, son todos disparadores de la iniciación de la vía mitocondrial intrínseca. Independientemente del estímulo, esta vía es el resultado de una permeabilidad mitocondrial aumentada y de la liberación de moléculas proapoptóticas tales como la citocromo-c hacia el citoplasma. Esta vía está estrechamente regulada por un grupo de proteínas que pertenecen a la familia Bcl-2. Hay dos grupos principales de proteínas Bcl-2, específicamente las proteínas pro-apoptóticas (Bax, Bak, Bad, Bcl-Xs, Bid, Bik, Bim y Hrk) y las anti-apoptóticas (Bcl-2, Bcl-XL , Bcl-W, Bfl-1 y Mcl-1) En tanto las proteínas anti-apoptóticas frenan la apoptosis bloqueando la liberación mitocondrial de citocromo-c, las proteínas pro-apoptóticas actúan promovieron la liberación de citocromo-c desde la mitocondria hacia el citoplasma. No es la cantidad absoluta, sino el balance entre las proteínas pro- y anti-apoptóticas lo que determina si se va a iniciar o no la apoptosis. Otros factores apoptóticos que se liberan desde el espacio intermembranoso mitocondrial hacia el citoplasma incluyen al factor inductor de apoptosis (AIF), al segundo activador de caspasa derivado de mitocondria (Smarc), a la proteína de unión al IAP directo con bajo ph (DIABLO) y la proteína A de requerimiento de alta temperatura /Omi (HtrA2). La liberación citoplasmática de citocromo-c activa a la
caspasa 3 por medio de la formación de complejo conocido como apoptosoma, que está conformado de citocromo-c, Apaf-1 y caspasa 9. Por otro lado, el Smac/DIABLO o la Omi/HtrA2, promueven la activación de la caspasa uniéndose al inhibidor de las proteínas de apoptosis (IAPs) que posteriormente lleva a la disrupción en la interacción de los IAPs con la caspasa 3 o 9.
La vía mitocondrial se ejecuta en respuesta a intromisiones externas y a daño en el DNA. Las distintas vías de respuesta convergen en la mitocondria, a menudo a través de la activación de miembros proapoptóticos de la familia de Bcl-2. Excepto Bcl-2, que está la mayoría del tiempo anclado a membranas intracelulares, algunos miembros de los grupos II y III, incluyendo Bax, Bad, Bim y Bid, pueden localizarse tanto en el citosol como en orgánulos (Gross A, 1999; Li H, 1998; Wolter KG, 1997; Puthalakath H, 1999). La forma citosólica de estas proteínas es un reservorio inactivo pero preparado para la batalla. Las señales proapoptóticas redirigen estas proteínas a la mitocondria donde tendrá lugar la lucha por el destino de la célula. La activación de miembros proapoptóticos puede producirse a través de proteolisis, defosforilación y probablemente otros mecanismos (Adams JM, 1998; Antonsson B, 2000). Los miembros pro y antiapoptóticos de la familia de Bcl-2 se encuentran en la superficie de la mitocondria donde regulan la salida del citocromo c por un mecanismo todavía debatido. Si los miembros proapoptóticos ganan, una gran cantidad de moléculas son liberadas desde la mitocondria. La principal de estas moléculas liberadas es el citocromo c, que se asocia con Apaf-1 y después con la procaspasa-9 (y posiblemente otras proteínas) para formar el apoptosoma. Las proteínas de choque térmico (heat-shock proteins, HSP) actúan en múltiples pasos regulando la apoptosis (Jaattela M, 1999; Xanthoudakis S, 2000). El apoptosoma hidroliza la procaspasa-3 a caspasa-3 que se encarga de ejecutar la apoptosis generando distintos subprogramas cuya suma resultará en el desmantelamiento ordenado y en la muerte de la célula
Agregar un comentario
28479